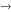Nincs élő szervezet, amely ne ribonukleinsav (RNS) molekulák révén állítaná elő a fehérjéket. A hírvivő RNS-ek (mRNS-ek) közvetítik a DNS-ben tárolt genetikai információt a fehérjéket előállító riboszómákhoz. Ugyanakkor a riboszomális RNS-ek (rRNS-ek) a riboszómák részeként és a transzfer RNS-ek (tRNS-ek) a szükséges aminosavak szállítása révén közvetlenül vesznek részt a fehérjeszintézisben. E három RNS-típus mellett a tudomány későre fedezte fel, hogy a sejtben számos kis szabályozó RNS is létrejön, amelyeknek egy nagy csoportja a többi RNS helyspecifikus módosítását irányítja. E biológiai szerep feltárásában ért el világszinten jegyzett kutatási eredményeket Dr. Kiss Tamás genetikus, a Szegedi Tudományegyetem alumnusa, a Szegedi Biológiai Kutatóközpont egykori munkatársa, ma a Toulouse-i Egyetem professzora.
– Professzor úr, szeretném megérteni, hogy az ön által kutatott kis szabályozó RNS-eknek milyen szerepe van a sejtben lejátszódó biológiai alapfolyamatokban. Hadd kezdjük onnan, hogy milyen az a környezet a sejt magjában, ahol az RNS-ek szintézise és érése történik?
– Képzeljünk el egy baktériumot: a sejtje valójában egy zsák, ami összekeverve tartalmazza az alkotóelemeket. Az eukarióta, azaz sejtmaggal rendelkező sejtekben viszont térben minden rendkívül rendezett és szigorúan elhatárolt. Például a sejtmagon belül található a nukleólusz vagy sejtmagvacska, ami voltaképpen egy membrán nélküli molekulacsoportosulás. Itt történik a riboszómális RNS-ek (rRNS-ek) szintézise, érése és működőképes riboszómákba csomagolása mintegy 80 riboszómális fehérjével. Az rRNS először egy hosszú prekurzor rRNS-ként, "elő RNS"-ként, íródik át. Ebben a 18S, 5,8S és 28S rRNS-ek sorban vannak beágyazva, és bonyolult enzimatikus érési folyamatok révén vágódnak ki. Eközben több mint kétszáz gondosan kiválasztott nukleotid kémiai módosítása is megtörténik mielőtt az rRNS beépülne a riboszóma kis és nagy alegységébe.
– Milyen evolúciós oka annak, hogy a sejt az RNS-eket nem az elsőre átíródott formájukban használja, hanem érniük kell?
– A sejtmagban szintetizált elsődleges RNS-termékek hosszabb-rövidebb külső és belső ”nem-kódoló” szakaszokat hordoznak. Az RNS-ek érése során ezeket el kell távolítani, hogy működőképes RNS-eket kapjunk. Például, a fehérje-kódoló gének átírásakor keletkező prekurzor-mRNS-ek kódoló szakaszait (exonok) hosszabb-rövidebb nem-kódoló-szakaszok (intronok) választják el egymástól. Az mRNS-ek érése során az intron régiókat ki kell vágni, és az exonok végeit össze kell kapcsolni. Ez a folyamatot hívjuk splájszingnak, összefonásnak. Néha, egyes exonok kimaradhatnak, míg más exonok bekerülhetnek az mRNS egy új változatába. Ezt a folyamatot alternatív szplájszingnak hívjuk; ami lehetővé teszi, hogy egy génről többféle fehérje képződhessen, ezzel jelentősen növelve a sejt fehérjeállományának szerkezeti és funkcionális sokféleségét.

A kis RNS-ek kategóriái. Forrás: Research Gate
– Hol van a szerepe ebben az snoRNS-eknek, amelyek funkcióját az ön kutatócsoportja írta le először Toulouse-ban?
– Az érés az RNS-ekre általánosan jellemző folyamat, nemcsak az rRNS, hanem majdnem minden RNS érik és átmegy a helyspecifikus kovalens nukleotid-módosításokon. Az emberi sejtben található RNS összes ribonukleotidjainak mintegy 5-6 százaléka módosított. A leggyakoribb két módosítás a ribóz molekulák 2’-hidroxil csoportjának metilációja és bizonyos uridin bázisok pszeudouridinná történő alakítása. Más szóval, az RNS-ek általában nem úgy íródnak át a DNS-ről, ahogyan később léteznek és működnek a sejtben. A 20. század végére sokat megtudtunk a prekurzor RNS-ek enzinmatikus vágásáról, éréséről, de a módosított nukleotidok helyspecifikus szintézise a biológia egyik nagy rejtélye maradt. Az én kutatócsoportom fedezte fel, hogy az rRNS-ek, a kis nukleáris RNS-ek (snRNS-ek) és néhány transzfer RNS (tRNS) ribóz metilációját és pszeudouridilációját kis nukleoláris RNS-ek (snoRNS-ek) irányítják. Az rRNS módosítást irányító snoRNS-ek a nukleóluszban koncentrálódnak, innen a nevük. Miután az érés során felépültek a riboszomális kis és nagy alegységek, a sejtmag membránjának pórusain a sejt citoplazmájába vándorolnak, ahol összeállnak funkcionális riboszómákká. Az mRNS-ek genetikai információit követve ezek a riboszómák fognak fehérjéket szintetizálni. A módosított nukleotidáknak tehát nagy szerepük van a módosított RNS-ek korrekt és hatékony működésében. Fontos szerepet játszanak a citoplazmában történő fehérjeszintézisben és a sejtmagban lejátszódó génkifejeződés minden lépésében.
– Hogyan kell elképzelni, hogy ebben a sokféleségben, RNS-ek, fehérjék, enzimek komplexében végül is viszonylag kevés összetevő végez el sokféle funkciót?
– Az snoRNS-ek valójában, irányító (guide) RNS-ek, amelyek kiválasztják a módosítandó nukleotidot. Az snoRNS bázispárosodik az adott RNS komplementer célszekvenciájával, majd az snoRNS-hez kapcsolódó RNS-módosító enzim elvégzi a kiválasztott nukleodidok módosítását, ami gyakran pszeudouridilálás vagy a ribóz metiláció. Így egyetlen enzim, több száz snoRNS segítségével, óriási számú nukleotid-módosítást tud végrehajtani a sejt RNS-eiben. Nem kell az evolúció során sok száz helyspecifikus RNS-módosító enzimet kifejleszteni. Ez nagyon nehézkes feladat lenne. Viszont az irányító RNS-ek célfelismerő (antiszensz) szakaszai könnyen gyűjthetnek össze annyi pontmutációt, ami már egy új felismerő szekvenciát, és egyben egy új snoRNS-t eredményez. A baktériumokban még minden nukleotidmódosítást egy-egy speciális fehérje enzim végez. A bakteriális RNS-ek általában sokkal kevesebb módosított nukleotidot hordoznak, mint az eukarióta RNS-ek, de még így is a baktérium genom 7-8 százaléka kódol RNS módosítási enzimeket. Sno-RNS-ek nélkül a humán RNS-módosításért felelős gének száma sokszorosa lenne a jelenleginek. Az RNS módosítást irányító snoRNS-ek bizonyos változatai részt vesznek egyéb folyamatokban is, például segítik az rRNS-ek precíz és hatékony kivágódását a prekurzor rRNS-ből, és irányítják a kromoszóma végi telomer DNS szintézisét, ezzel kontrollálva az egészséges sejtek élettartamát vagy stimulálva a rákos sejtek szaporodását.

Dr. Kiss Tamás interjút ad a szegedi mRNS konferencián. Fotó: Kovács-Jerney Ádám
– Egyetért az ún. RNS-világ hipotézissel, amely szerint az élet evolúciójának egy nagyon korai fázisában, amikor még nem volt DNS és nem létezett a fehérjék lefordítása, egyedül az RNS-molekulák biztosították az információ tárolását?
– Igen, ez egy teljesen logikus és mára általánosan elfogadott elmélet, tekintve, hogy az RNS az egyetlen biomolekula, amely egyaránt képes enzimatikus reakciókat katalizálni és genetikai információt tárolni.
– Vannak RNS-típusok, amelyeknek még nem ismerik a szerepét vagy akár teljesen ismeretlenek?
– Rengeteg nem-kódoló RNS (ncRNS) van a humán sejtben. Közülük a kis RNS-ekből nem lehet már sok ismeretlen, de a hosszú RNS-ekből igen. A hosszú nem-kódoló RNS-ek (lncRNS) úgy néznek ki, mint a klasszikus messenger RNS-ek, van 3’-végi poly(A) szekvenciájuk és 5’-végi sapkájuk, de limitált fehérjekódoló kapacitással rendelkeznek, mert nem tartalmaznak hosszú nyitott fehérjeleolvasási kereteket. Persze ez nem zárja ki a lehetőséget, hogy rövid oligopetidek átíródhatnak róluk. Jobbára bizonyos fehérjékkel összekapcsolódva találhatók a sejtben, és változatos szabályozó fukciókat látnak el. A Xist lncRNS például, a nők egyik X kromoszómájának átírását blokkolja (csendesíti), hogy elejét vegye a nem kívánatos kromoszóma dózishatásnak. Egyébként több más lncRNS is részt vesz bizonyos kromoszómaszakaszok átírásának szabályozásában. Vannak lncRNS-ek, amelyek fehérjék aktivitását, sejten belüli lokalizációját, vagy más RNS-ek érését támogatják, míg sokan mások bizonyos sejtorganellumok szerkezetének kialakulását és fenntartását szabályozzák.
– Lát még megoldatlan problémákat az RNS-ek kutatása terén?
– Az snoRNS szerepét a riboszómális rRNS érésében már 1990-as években felfedeztük, mégis vannak még érdekes részletei. Az RNS fantasztikus molekula, hihetetlenul dinamikus, gyorsan tudja a terbeli szekezetét változtatni. A csoportom nemrégiben fedezte fel, hogy az RNS módosítást irányító snoRNS-ek képesek dinamikus alternatív struktúrákat létrehozni a célszevenciákkal, és ezáltal több cél nukleotid specifikus módosítását tamogatni. Továbbá az RNS képes biokémiai reakciókat katalizálni, akárcsak egy klasszikus fehérje enzim. A fehérjeszintézist végző riboszóma például valójában egy RNS-enzim, a riboszomális fehérjék tulajdonképpen csak segitik az rRNS működését. A fehérjeszintézis tehát egy RNS által katalizált folyamat. És ugyanúgy az rRNS-ek splájszingja, amit a kis nukleáris RNS-ek katalizálnak.
A biológia központi dogmája
Amikor egy sejtnek szüksége van egy fehérjére, a genetikai kódot hordozó DNS megfelelő részét a sejtmagban lemásolja különböző RNS-ekbe. Az így átírt RNS egy sor érési lépésen megy keresztül, és ennek során a sokáig rejtélyes szerepű kis szabályozó RNS-ek vesznek részt a ribonukleotidok módosításában. (A ribonukleotidok az RNS alapegységei.) Az egyik leggyakoribb módosítás az RNS egyik nukleotidának, az uridinnek az átalakítása pszeudouridinné. Ez a természetes módosítás valójában ugyanaz, mint amit Karikó Katalin mesterséges úton módosított a hírvivő RNS-en, hogy kikerülje a szervezet túlzott immunválaszát. Az érett RNS ezután kijut a sejtmagból a citoplazmába, ahol a fehérjék szintézise történik. A genetikai információ áramlását a DNS-től, az RNS-en keresztül a fehérjéig a molekuláris biológia központi dogmájaként ismerjük.
– Professzor úr, önről Karikó Katalin előadásaiban gyakran elmondja, hogy az ön RNS-kutatásai inspirálták őt a módosított mRNS felfedezésében. Ebben az interjúban már említette az uridin nukleotid átalakulását pszeudouridinné. Végül is ugyanezt a módosítást végezte el Karikó Katalin mesterséges úton a hírvivő RNS-en, hogy kikerülje a szervezet túlzott immunválaszát. Ez a természetes folyamat „ötletadója” volt a későbbi Nobel-díjas felfedezésnek?
– Ha jól emlékszem, a módosított nukleotidák jelentősége az RNS által indukált gyulladás elkerülésében akkor merült fel, amikor Katiék azt találták, hogy a szövetekbe injektált transfer RNS (tRNS), ellentétben más RNS-ekkel, nem bizonyult immunogénnek. Mivel a tRNS a legintenzívebben módosított RNS a sejtben, és a pszeudouridin a leggyakoribb módosított nukleotid benne, logikus volt feltételezni, hogy a módosításoknak vagy a pszeudouridineknek közük lehet az agresszív immunválasz elkerüléséhez. Kati megkeresett, hogy van-e olyan enzimem, ami képes egy RNS-molekula össszes uridinját pszeudouridinná alakítani. Azt kellett valaszolnom, hogy sajnos ilyen enzimet még senki nem talált, és valószínűleg nem is létezik. A mi pszeudouridilációs irányító snoRNS/fehérje komplexumaink csak egy meghatározott uridint tudnak átalakítani az RNS-ben. Felvetettem, hogy a T3, T7 vagy SP6 bakteriofágok RNS polimerázaival kellene átíratni teszt mRNS-eket pszeudouridin trifoszfát jelenlétében. Bár ez egy rutin eljárás volt RNS-ek kémcsőben történő előállítására, arról fogalmam sem volt, hogy a fág RNS polimerázok elfogadnak-e pszeudouridin trifoszfátot uridin trifoszfát helyett.

Fotó: Kovács-Jerney Ádám
– Meglepő volt, amit előadásában említett, hogy az Epstein-Barr-vírus saját snoRNS-e képes irányítani a gazda riboszomális RNS-ének ribóz metilálását és ezáltal módosítani a fertőzött sejt fehérjeszintézisét. Hogyan történik ez?
– A vírus nem veszi át a transzlációt, hanem csak módosítja a humán gazdasejt transzlációs rendszerét. A vírus snoRNS-e, azáltal, hogy módosítja a riboszomális rRNS-t, megváltoztatja az emberi riboszóma funkcióját a fertőzött sejtekben. Azt még nem tudjuk, hogy ez miért jó a vírusnak, de már bíztató kutatásokat folytatunk. Ehhez virális szakembert kellett bevonnunk, hiszen mi molekuláris biológusok vagyunk, eddig egy sejtmodellt vizsgálunk, egy rákos sejtet, amiben az Epstein-Barr-vírus teljes genomja expresszálódik. Magával a vírussal biztonsági okokból nem dolgozhattunk az intézetünkben.
– A vírus genomja szintén rendelkezik saját snoRNS-ekkel? Milyen evolúciós története van ennek?
– A vírusnak csak ez az egy snoRNS-e van, és ez nyilván humán eredetű. Az ember snoRNS génjei a fehérje-kódoló gének intron régióiban foglalnak helyet. Az snoRNS-ek a gazdagén prekurzor mRNS-einek részeként íródnak át, és abból vágódnak ki. Az snoRNS szekvencia tartalmazza az összes információt, ami a korrekt kivágáshoz, hatékony akkumulációhoz és RNS módosításhoz szükséges. Feltételezésünk szerint egy humán snoRNS-gén ékelődött be a virális genomba. Később spontán pontmutációk révén egy olyan célszekvencia felismerő elem alakult ki, amely a gazda riboszómát a vírus számára előnyösen módosította. A vírusok igyekeznek a minimális szükséges genetikai információt hordani, mert a genomjuk mérete behatárolt. A vírus DNS-nek be kell pakolódnia a víruskapszidba, nem tud összeszedni egy jókora genomot. Az Epstein-Barr-vírusba egy körülbelül 172 kilobázisnyi DNS fér bele, és ami abban van, annak fontosnak kell lennie. A mi humán genomunk mérete jóval nagyobb, és a fejlődés következtében tele is van mindenféle maradvánnyal. Sok olyan szekvenciája van, ami látszólag semmire sem jó, legalábbis még nem tudjuk a szerepét.
- Az előadásában megjelölt más rákkutatási területeket is, amelyekben szerepet játszhat az snoRNS-ek jobb megértése. Lehet-e az snoRNS biomarker egyes ráktípusok előrejelzésében?
– Az elmúlt évtizedben több tucat snoRNS-t hoztak összefüggésbe különböző típusú rákbetegségek kialakulásával, előrehaladásával. A kutatók rengeteg RNS-mintát szekvenálnak rákos sejtekből, és ebből a nagy mennyiségű adatból figyelik, hogy bizonyos ráktípusokban az snoRNS-ek akkumulációja megváltozik-e, sokkal több, vagy sokkal kevesebb van-e belőluk. Az emelkedett snoRNS szint azt jelentheti, hogy az adott snoRNS segíti a rák fejlődését. Bizonyos ráktípusokra leírtak jellegzetes snoRNS akkumulációs mintázatokat. Az snoRNS-ek rákban játszott szerepének molekuláris háttere azonban még teljesen ismeretlen. Feltehetően az általuk irányított RNS-módosításokkal van összefüggésben.
– Az idén kiosztott Nobel-díjakat a mikro-RNS-ek (miRNS) felfedezéséért adták. Azt hallottam, hogy az ön kutatása egy előlépése volt a miRNS-ek azonosításának.
– Amikor a mikro-RNS-t leíró első cikk kijött a Science-ben, azt én bíráltam. Gondolkodtam is akkor, hogy át kellene-e állni a miRNS-ek kutatására, de sok projektem volt, pénzem, munkatársam pedig kevés, így nem mozdultam. Valójában a miRNS-eseket már a mi kutatócsoportunk is látta korábban, de nem tudtuk, hogy mik azok. Amikor humán snoRNS-eket klónoztunk, a nukleóluszból származó RNS-ek mindkét végéhez egy rövid mesterséges RNS-molekulát kapcsoltunk egy RNS ligáz nevű enzim segítségével. Gyakran azt tapasztaltuk, hogy az snoRNS és a kapcsolt mesterséges RNS közé egy 20-22 nukleotidányi ismeretlen szekvencia ékelődött be, ami mintha a Holdról jött volna, mert az snoRNS génjében, amennyiben az ismert volt, nem volt jelen. Sajnos ekkor a humán genom szekvenciája még csak részben volt ismert. Arra gondoltunk, hogy ezek a kis RNS molekulák a természetes RNS degradáció köztes termékei lehetnek. Később, amikor 1993-ban leírták a miRNS-eket, akkor mentünk vissza, és megállapítottuk, hogy bizony a leggyakoribb humán mikroRNS-eket láttuk tíz évvel a felfedezésük előtt.
– Bosszantó volt?
– Nem volt nagyon bosszantó, mert tulajdonképpen fogalmunk sem volt, hogy mit látunk. Eszünkbe sem jutott azt feltételezni, hogy biológiailag releváns RNS-eket fedeztünk fel. Elvégre, amikor én jártam egyetemre, még azt tanították, hogy a transzfer RNS-eknél rövidebb RNS-ek nincsenek a sejtben, ami persze nem igaz.

Dr. Kiss Tamás genetikus. Fotó: Kovács-Jerney Ádám
– Miben különbözött egykori munkája a Szegedi Biológiai Kutatóközpontban attól, amit később Bázelben, majd Toulouse-ban tapasztalt?
– Először is az SZBK-ban akkoriban mindent magunknak kellett megoldanunk, ezért aztán a kutatási témáink és az alkalmazott kísérleti módszereink minden részletét ismertük. Ha egy kutató Nyugaton dolgozott, csak elővette a katalógust és megrendelte a szükséges reagenst és enzimet. Nekünk évente csak egyszer lehetett ”valutás” vegyszereket rendelni. Sokszor megtörtént, hogy egy enzimet én magam tisztítottam. Ha mondjuk dohány savas pirofoszfatáz enzim kellett, ami le tudja vágni az RNS-ek 5’-vegi sapkáját, azt meg kellett volna rendelni külföldről valutáért. Mi viszont lementünk az üvegházba, kértünk egy tálca dohányt, és nekiálltunk tisztítani. Ha nem sikerült, kezdhettük újra, viszont az ember így pontosan tudta, mit csinál. Nyugat-Európában eközben kitekből dolgoztak; a zöld csőből hozzáadtak két mikrolitert, a sárgából egy mikrolitert, ahogy a protokol írta, és a PhD-hallgatók sokszor nem tudták, hogy mit csinálnak, és mi történik a reakciócsövekben. Én viszont a Reanal által szállított kétes tisztaságú vegyszerekből és enzimekből magam állítottam elő munkaigényes tisztítási folyamatokkal molekuláris biológiai minőségű reagenseket. Rengeteget dolgoztam, de sokat tanultam belőle. Ugyanakkor persze iszonyú sok időt is veszítettem. Az eredmények szempontjából ez veszteség, mert aki leveszi a polcról, vagy a hűtőből a tökéletes reagenseket, sokkal gyorsabban halad, mint aki maga kezdi el tisztítani őket. Ezzel szemben nagy előnye volt a szegedi ”szükségiskolának”, hogy képes lettem megtervezni új molekuláris biológiai protokollokat, nem csak a meglevőket követni.
Névjegy
Kiss Tamás az INSERM francia orvosi kutatóintézet kutatási igazgatója. Az Europai Molekuláris Biológiai Szervezet (EMBO) választott tagja. A Magyar Tudományos Akadémia doktora. A Szegedi Tudományegyetem Természettudományi Karán szerzett diplomát. Alap- és posztgraduális képzésben részesült a Magyar Tudományos Akadémia Szegedi Biológiai Kutatóközpontjában, ahol növényi kis nukleáris RNS-eket (snRNS) fedezett fel és jellemzett prof. Solymosy Ferenccel. Posztdoktori kutatásait Dr. Witold Filipowicz professzorral a bázeli Friedrich Miescher Intézetben a növényi snRNS-gének RNS-polimeráz-szelekciójának megértésére összpontosított. Az elsők között volt, akik felfedezték az intronok által kódolt humán kis nukleoláris RNS-eket (snoRNS-ek). Később a Laboratoire de Biologie Moléculaire Eucaryote du CNRS, Toulouse csoportvezetőjeként számos humán kis nukleáris RNS-t fedezett fel és jellemzett elsőként. Több új és régebben ismert kis nukleáris RNS funkcióját fejtette meg és írta le az emberi génkifejeződésben játszott szerepüket. Kimutatta, hogy az intronikus snoRNS-ek irányítják az rRNS-ek 2'-O-metilációját és pszeudouridilációját. Leírta a Cajal-testekben felhalmozódó és a splájszoszómális snRNS-ek közvetlen módosítását irányító RNS-ek új osztályát.
Panek Sándor
A borítóképen: Dr. Kiss Tamás genetikus, a Toulouse-i Egyetem professzora. Fotó: Kovács-Jerney Ádám